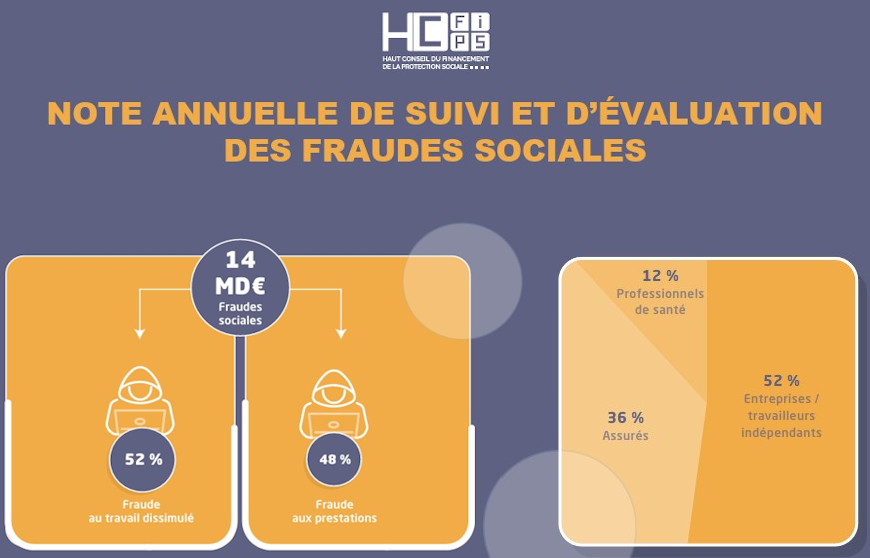
Le Comité indépendant de surveillance des données (DMC) a validé la poursuite de l’essai clinique Audiogene. Sensorion en a profité pour donner des nouvelles des jeunes patients traités.
Le DMC n’a émis aucune observation de sécurité concernant l’essai clinique de Phase 1/2 Audiogene (Institut Pasteur-AP-HP) sur le SENS-501, programme de thérapie génique pour traiter une forme de surdité liée à des mutations génétiques provoquant un déficit en otoferline. Cette revue de données inclut notamment la 2ème cohorte de 3 patients âgés de 6 à 31 mois, qui ont reçu la dose 2 du SENS-501 (4,5E11 vg/vecteur/oreille). Les enfants de deux cohortes ont bien toléré l’administration intracochléaire, sans incident ni événement indésirable grave. Aucun effet secondaire grave n’a été signalé.
Des améliorations directionnelles précoces en audiométrie tonale ont été observées au troisième mois chez deux des trois patients de la deuxième cohorte : un seuil auditif comportemental d’environ 60 dB HL à la fréquence la plus performante chez l’un d’eux, tandis qu’un autre présente un seuil d’environ 70 dB HL à la fréquence la plus performante. Sensorion prévoit d’analyser les données d’efficacité à six mois et de communiquer les résultats au premier trimestre 2026, une fois les données jugées suffisamment matures.